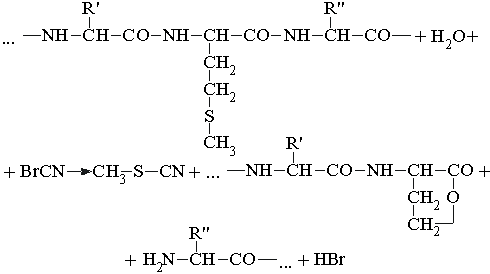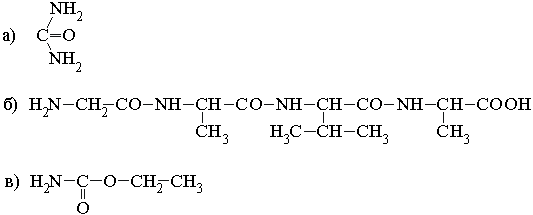а) Нарисуйте
структурную формулу пептида Ala-Ala-Ala. Укажите
функциональные группы, которым соответствуют
величины рК'1 и рК'2.
б) При переходе от Ala к
олигопептидам, состоящим из остатков Ala, величина
рК'1 возрастает. Объясните, почему это
происходит.
в) При переходе от Ala к
олигопептидам, состоящим из остатков Ala, величина
рК'2 уменьшается. Объясните причину этого.
33. Уильям Астбери
первым заметил, что рентгенограмма шерсти
указывает на присутствие структурной единицы,
повторяющейся вдоль волокна с интервалом около
0,54 нм. После растяжения шерсти, подвергнутой
действию пара, на рентгенограмме появлялись
признаки изменения периодичности структуры:
новая структурная единица повторялась через
каждые 0,70 нм. После того, как обработанная паром
шерсть укорачивалась, на рентгенограмме снова
возникала периодичность около 0,54 нм. Хотя эти
наблюдения послужили ключом к пониманию
молекулярной структуры шерсти, в то время
Астбери не смог их интерпретировать. Исходя из
современных данных о структуре шерсти, объясните
эти наблюдения.
34. Считается, что волос
человека растет со скоростью 15-20 см в год. Зона
роста находится у основания волоса, где в клетках
эпидермиса синтезируются a -кератиновые нити,
скручивающиеся затем наподобие канатов.
Основным структурным элементом a -кератина
является a -спираль, шаг которой составляет 0,54 нм,
а на виток приходится 3,6 аминокислотных остатков.
Предположив, что фактором, лимитирующим рост
волос, служит биосинтез a -спиральных цепей
кератина, рассчитайте скорость образования
пептидных связей в цепях a -кератина (число
пептидных связей в 1 с), которая могла бы
обеспечить наблюдаемое удлинение волос за 1 год.
35. Содержание цистина
определяет механические свойства многих белков.
В молекулах целого ряда природных белков
содержится большое число остатков цистина. При
этом наблюдается корреляция между механическими
свойствами белков (прочностью на разрыв,
вязкостью, твердостью) и содержанием цистина.
Например, глутенин (богатый цистином белок
пшеницы) определяет вязкость и эластичность
теста, приготовленного из пшеничной муки. Точно
так же твердый и прочный панцирь черепахи обязан
этими свойствами высокому содержанию цистина в a
-кератине, из которого он состоит. Какова
молекулярная основа наблюдаемой корреляции
между содержанием цистина и механическими
свойствами белка?
36. Если шерстяной
свитер или шерстяные носки постирать в горячей
воде, а затем высушить в электросушилке, они
становятся меньше. Исходя из того, что известно о
структуре a -кератина, как объяснить это явление?
Вместе с тем шелк при тех же условиях не дает
такой усадки. Объясните, почему.
37. Большинство
глобулярных белков при кратковременном
нагревании до 65о С денатурирует с полной
потерей активности. Однако те глобулярные белки,
в которых содержится много остатков цистина,
денатурируют только при более длительном
нагревании до более высоких температур. Одним из
таких белков является рибонуклеаза, содержащая
124 аминокислотных остатка в единственной
полипептидной цепи, в которой имеется четыре
поперечные дисульфидные связи, образованные
остатками цистина. Чтобы полипептидная цепь
рибонуклеазы развернулась, необходимо нагреть
содержащий ее раствор до высокой температуры.
Если затем быстро охладить его, то
ферментативная активность восстанавливается.
Можете ли Вы указать молекулярную основу такого
поведения?
38. При благоприятных
условиях бактерия Halobacterium halobium синтезирует
мембранный белок бактериородопсин (мол.масса
26000). Молекулы этого белка, имеющего пурпурный
цвет, обусловленный присутствием в них ретиналя,
образуют в клеточных мембранах агрегаты в виде
пурпурных "заплаток". Бактериородопсин
действует как активируемый светом протонный
насос и таким образом снабжает клетки энергией.
Показано, что этот белок состоит из семи
параллельных a -спиральных сегментов,
пронизывающих мембрану бактериальной клетки
толщиной 4,5 нм. Рассчитайте минимальное число
аминокислот, которое должно содержаться в одном
сегменте a -спирали, чтобы он мог полностью
пронизывать мембрану. Оцените, какая доля
аминокислотных остатков бактериородопсина
участвует в образовании a -спиральных сегментов
(средняя молекулярная масса одного
аминокислотного остатка равна 110). Приведите
обоснование Ваших расчетов.
39. Патогенные бактерии
Clostridium perfringens, являющиеся возбудителями газовой
гангрены, при которой происходит разрушение
тканей, выделяют фермент, эффективно
катализирующий гидролиз пептидной связи
(выделено жирным шрифтом) в последовательности:
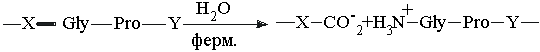
где X и Y - любая из 20
аминокислот. Каким образом этот секретируемый
фермент помогает бактерии проникать в ткани
человека? Почему этот фермент не приносит вреда
самой бактерии?
40. Глобулярные белки
характеризуются определенным расположением
специфических аминокислот. По данным
рентгеноструктурного анализа миоглобина и
других одноцепочечных глобулярных белков
небольших размеров был сделан ряд обобщений,
касающихся укладки полипептидных цепей
растворимых белков. Исходя из этих обобщений,
укажите наиболее вероятное расположение (внутри
или на поверхности молекулы нативного
глобулярного белка) аминокислотных остатков
аспарагиновой кислоты, лейцина, серина, валина,
глутамина и лизина. Поясните свой ответ.
41. Олигомерный белок
массой 660 мг обрабатывали избытком
2,4-динитрофторбензола в слабощелочной среде до
завершения химической реакции. Затем пептидные
связи белка были подвергнуты полному гидролизу
путем нагревания белка в присутствии
концентрированной HCl. В гидролизате содержалось
5,5 мг следующего соединения:
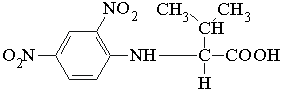
Никаких других
2,4-динитрофенильных производных, образующихся в
реакции с a -аминогруппами аминокислот,
обнаружено не было.
а) Объясните, почему
эти данные можно использовать для определения
числа полипептидных цепей в олигомерном белке.
б) Рассчитайте число
полипептидных цепей в этом белке (молекулярная
масса 132000).
42. Первое указание на
то, что белки по молекулярной массе намного
превосходят известные в то время органические
соединения, было получено более 100 лет назад.
Например, уже тогда было известно, что гемоглобин
содержит 0,34 % (по весу) железа.
а) Исходя из этой
информации, определите минимальную молекулярную
массу гемоглобина.
б) Последующие
эксперименты показали, что истинная
молекулярная масса гемоглобина равна 64500. Какую
информацию отсюда можно извлечь о числе атомов
железа в гемоглобине?
43. Препарат мутантного
гемоглобина подвергли трипсиновому гидролизу, а
затем получили пептидную карту. При этом
выяснилось, что мутантный гемоглобин отличается
от нормального гемоглобина А тем, что содержит в
одном из пептидов вместо остатка аспарагина
остаток лизина.
а) Для чего проводится
гидролиз гемоглобина трипсином?
б) Как можно было бы
выявить этот мутантный гемоглобин более быстрым
и простым способом?
44. Изобразите полные
структуры следующих пептидов (ионизуемые группы
изобразите в протонированном состоянии):
а)метионилглутамин,
б)глутамиласпартилфенилаланин,
в)phe-arg-trp-ile.
45. Полипептид, сильно
сорбирующийся на колонке с сильнокислотным
катионообменником при рН 3,5 можно вымыть с
колонки, пропуская буфер с рН 8.
Объясните почему.
46. На рисунке
изображена кривая титрования глутаминовой
кислоты. Найдите:
а) три значения рКа,
б) значение рН, при
котором будут существовать эквимолярные смеси
частиц с зарядом -1 и -2,
в) область значений рН,
в которой глутаминовая кислота заряжена
отрицательно,
г) область рН, в
которой сопряженная кислотно-основная пара
глутаминовой кислоты с зарядами 0 и -1 обладает
свойствами буферной смеси.
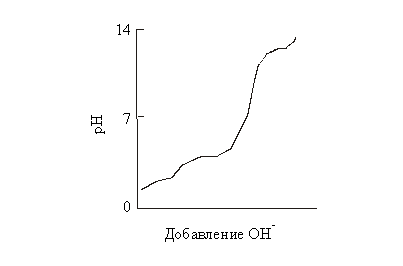
47. Обработка каким
агентом (трипсином, химотрипсином, протеазой Fm,
протеазой Sa или CNBr) приведет к образованию из
большой полипептидной цепи инсулина смеси
октапептида, нонапептида и тридекапептида?
При какой обработке
вообще не будет расщепления?
48. Для построения
калибровочной кривой для определения молярных
масс методом ДСН-электрофореза использованы
четыре чистых белка. Молекула белка 1 (М 15000) была
самая маленькая. Подвижность белка 2 (М 35000)
составляла 39%, подвижность белка 3 (М 25000) - 63%,
подвижность белка 4 (М 20000) - 81% подвижности белка
1.
Постройте
калибровочный график и определите молярную
массу неизвестного белка, который в тех же
условиях движется точно посредине между белками
2 и 3.
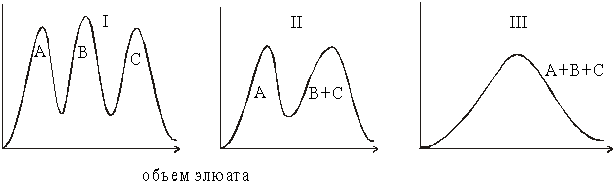
49. Раствор, содержащий
белки, анализируется методами ДСН-электрофореза
в ПААГ и катионообменной колоночной
хроматографии. Полученные при этом результаты
приведены на рисунке.
Какие выводы о составе
исходного раствора белков можно сделать?
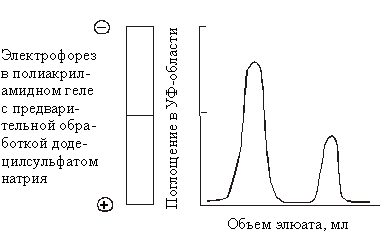
50. Пентапептид,
образующийся при обработке белка трипсином,
содержит аргинин, аспарагиновую кислоту, лейцин,
серин и тирозин. Для определения аминокислотной
последовательности провели три
последовательных расщепления по Эдману.
Полученные после
каждого расщепления пептиды имели следующий
состав:
первое расщепление -
аргинин, аспарагиновая кислота, лейцин, серин;
второе расщепление -
аргинин, аспарагиновая кислота, серин;
третье расщепление -
аргинин, серин.
Какова
последовательность пентапептида?
51. Объясните, почему
карбонильный атом кислорода и иминогруппа одной
и той же пептидной связи не образуют водородной
связи друг с другом.
52. Фермент был очищен
до постоянной удельной активности; другие методы
анализа подтвердили чистоту выделенного белка.
Электрофорез в полиакриламидном геле образца,
полученного на последней стадии очистки, выявил
наличие в окрашенной пластине геля одной
основной зоны и двух минорных. Более того, белок
каждой из трех зон катализировал одну и ту же
реакцию.
Какой вывод из этого
следует?
53. Нарисуйте следующие
структуры, стабилизированные водородными
связями:
а) димер уксусной
кислоты;
б)
тирозин-карбоксилатную группу в молекуле белка;
в) ионную
фосфат-гуанидиновую пару в фермент-субстратном
комплексе;
г) пары оснований GC и GU
(помните, что пара GU не укладывается в схему
Уотсона-Крика).
54. Попробуйте
предсказать, в какой конформации скорее всего
окажутся приведенные ниже пептидные фрагменты в
белке - в a -спирали или в составе b -структуры:
а) поли-L-лейцин;
б) поли-L-валин;
в) Pro-Glu-Met-Val-Phe-Asp-Ile;
г) Pro-Glu-Ala-Leu-Phe-Ala-Ala;
55. Сравните
растворимость в воде и в эфире аминокислот и
насыщенных жирных кислот и их физическое
состояние.
Как эти различия
связаны со структурой указанных соединений?
56. Какие
функциональные группы встречаются в боковых
цепях белков? Каково структурное и
функциональное значение:
а) гидрофобных групп;
б) кислых и основных
групп;
в) сульфгидрильных
групп.
57. Перечислите
названия всех изомерных трипептидов, содержащих
по одному остатку тирозина, аланина и валина.
58. Напишите
структурную формулу
глицил-L-триптофанил-L-пролил-L-серил-L-лизина.
а) Какие аминокислоты
можно получить из этого пептида в результате
кислотного гидролиза?
б) В результате
щелочного гидролиза?
в) В результате
обработки азотистой кислотой с последующим
кислотным гидролизом?
г) Куда будет
смещаться этот пептид на электрофорезной
пластинке при рН 7,0 - к катоду или к аноду? Чему
примерно равна его изоэлектрическая точка?
59. Сравните
структурные особенности и свойства следующих
белков:
фиброина шелка,
a -кератина,
коллагена,
бычьего сывороточного
альбумина.
60. Как обычно меняется
растворимость белков с изменением рН? Почему?
61. Располагая
некоторым количеством агарозы, бромциана,
6-амино-гексановой кислоты и другими
компонентами, необходимыми для проведения
аффинной хроматографии, укажите, какие
химические реакции должны обеспечить связывание
триптофана через его аминогруппу.
62. Имеются препараты,
по 50 мг каждого, двух чистых железо-серных белков
- рубредоксина и ферредоксина.
Опишите простой
химический тест, позволяющий различить эти два
вещества.
63. В нерастворимый
фосфопротеид мозга крысы во время сна включается
больше радиоактивного Рi, чем во время
бодрствования. Этот фосфопротеид был выделен и
оказался глюкозо-6-фосфатазой.
Как объяснить это
явление? Попытайтесь объяснить состояние сна с
химической точки зрения.
64. Изменение одной и
той же особенности поведения организма
наблюдается при мутации одного из генов,
детерминирующих синтез любого из следующих
белков:
аденилатциклазы,
фосфодиэстеразы,
ферментов синтеза
простагландинов,
моноаминооксидазы,
белка - рецептора cAMP,
протеазы, действующей
на липотропин.
Объясните
молекулярную основу общности эффекта мутаций.
65. Известно, что АТР и
фосфокреатин служат источником энергии в мышцах.
При сокращении скелетной мышцы в ней снижается
концентрация фосфокреатина, тогда как
концентрация АТР остается практически
постоянной. Объясните, как это происходит.
Роберт Дэвис в своих
классических опытах показал, что после
предварительной обработки мышцы
фтор-2,4-динитробензолом концентрация АТР в ней
быстро падает, тогда как концентрация
фосфокреатина остается неизменной на протяжении
серии сокращений. Попытайтесь объяснить это.
66. Какие аминокислоты
в растворе дают кислую реакцию:
а) аланин;
б) валин;
в) глютаминовая
кислота;
г) лейцин;
д) аспарагиновая
кислота.
Почему? Напишите
формулы этих аминокислот.
67. Какие аминокислоты
обладают основными свойствами:
а) лейцин;
б) треонин;
в) гистидин;
г) лизин;
д) метионин;
е) гидроксилизин;
ж) аргинин?
Почему? Напишите их
формулы.
68. Как будет
мигрировать белок при проведении электрофореза
в условиях, когда рН раствора ниже
изоэлектрической точки:
а) к аноду;
б) к катоду;
в) остается на лини
старта;
г) образует биполярный
ион?
69. Что является
простетической группой гемоглобина:
а) четыре пиррольных
кольца, соединенных с Fe3+;
б) протопорфирин;
в) четыре
алкилированных пиррольных кольца, соединенных с
метиновыми группами и Fe2+?
70. Какие из отмеченных
свойств характерны для денатурированных белков:
а) наличие водородных
связей;
б) наличие пептидных
связей;
в) вторичная и
третичная структура;
г) хорошая
растворимость в воде?
71. Какие свойства
характерны для белков:
а) коллоидные;
б) независимость от
изменения рН и повышения температуры;
в) наличие свободных
аминогрупп, принадлежащих e -аминогруппе остатка
лизина, и свободных карбоксильных групп,
принадлежащих остаткам аспартата и глутамата;
г) обусловленность
специфических свойств аминокислот наличием
пептидных связей в них;
д) закономерный
характер расположения аминокислот в
полипептидных цепях;
е) высокая
специфичность первичной структуры;
ж) незначительное
количество в белковых молекулах иных
ковалентных связей, кроме пептидных?
72. Главные свойства
альбуминов (А), глобулинов (Б), проламинов (В):
а) нерастворимы в воде,
растворимы в 70-80% спирте;
б) хорошо растворимы в
воде;
в) нерастворимы в воде
и солевых растворах умеренных концентраций.
73. Какова роль
различных связей и взаимодействий в молекуле
белка - ковалентных (А), ионных связей и
гидрофобных взаимодействий (Б),
внутримолекулярных и водородных связей (В),
межмолекулярных водородных связей (Г):
а) соединение белковой
и небелковой составляющей в молекулах
липопротеидов;
б) присоединение
аминокислот в белковой молекуле;
в) обеспечение
складчатой b -структуры полипептидной цепи;
г) обеспечение a
-спиральной конфигурации полипептидной цепи?
74. Смесь глицина,
аланина, глутаминовой кислоты, лизина, аргинина и
серина разделяли методом электрофореза на
бумаге при рН 6,0. Укажите, какие соединения
двигались к аноду - А (а), к катоду - К (б),
оставались на старте - С (в).
75. Какое из указанных
веществ является пептидом? Дайте ему название:
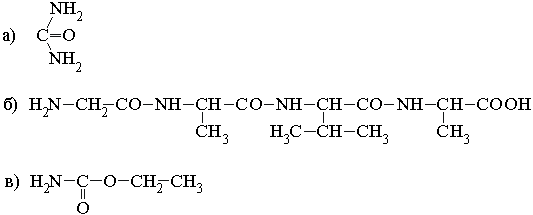
76. Тетрапептид
содержит аланин, лизин, пролин и валин. В
результате реакции тетрапептида с
динитрофторбензолом и последующего гидролиза
ДНФ-пептида раствором соляной кислоты (6 моль/л)
был получен ДНФ-аланин. Гидролиз тетрапептида
трипсином дает два соединения, одно из которых
окрашивается нингидрином в сине-фиолетовый, а
другое - в желтый цвет. Какова первичная
структура тетрапептида?
77. В гидролизате
пептида найдены аланин, валин, глутамат,
фенилаланин, тирозин, глицин, лизин, лейцин,
метионин и NH3. При обработке пептида по
методу Сэнгера выявлен ДНФ-аланин,
карбоксипептидазой - глицин. В триптическом
гидролизате обнаружено два пептида: первый
состоит из вал, ала, гли, лиз, фен.
Второй состоит из мет, гли, лей, тир, а при
обработке по Сэнгеру дает ДНФ-лейцин. В
химотриптическом гидролизате найдено три
пептида: первый содержит мет, гли; второй - вал,
ала, фен, глн; третий - лей, тир, лиз.
Выведите на основании всей совокупности данных
первичную структуру исходного пептида.
78. Определите
минимальную молекулярную массу гемоглобина
свиньи, если концентрация железа 0,4%, серы - 0,48%.
79.Молекулярные
механизмы действия белковых факторов роста пока
неясны, однако отдельные этапы процесса
поддаются экспериментальному исследованию.
Например, ФРЭ (фактор роста эпителиальных клеток)
стимулирует пролиферацию эпителиальных клеток
многих типов при первом связывании с рецепторами
ФРЭ на их поверхности. Роль рецептора ФРЭ в
распространении сигнала пролиферации теперь
проясняется благодаря изучению самого
рецептора. При этом широко используют клеточную
линию А-431 мышиных фибробластов, содержащих
необычайно большое число рецепторов ФРЭ, что
существенно облегчает их исследование.
Рассмотрим следующую серию экспериментов.
1. Препараты
плазматических мембран из клеток А-431 содержат
много белков, как показывает их анализ в ДСН-геле
(см. рис. А). Однако при добавлении к такому
препарату 125I-ФPЭ в присутствии агента,
сшивающего белки, метку включают только два
белка (рис. Б, первая дорожка). При добавлении к
среде инкубации избытка немеченого ФРЭ метка в
полосе 170 кДа исчезает (рис. Б, вторая дорожка).
2. Если препарат
мембран инкубировать с g -32Р-АТР, то
некоторые белки, в том числе и белок с мол. массой
170 кДа, фосфорилируются. Включение в состав
инкубационной смеси ФРЭ приводит к
существенному ускорению этой реакции.
3. Если осадить белок 170
к Да с помощью специфичных к нему антител и затем
повторить инкубацию осадка с g -32Р-АТР, то
белок 170 кДа фосфорилируется в ходе
ФРЭ-стимулируемой реакции (рис. В, дорожка 3 и 4).
4. Если осажденный
антителом белок вначале разгоняют в ДСН-геле, а
затем ренатурируют в этом геле, то последующая
инкубация с g -32Р-АТР в присутствии и в
отсутствие ФРЭ приводит к такому же
распределению, как приведенное на рис. В.
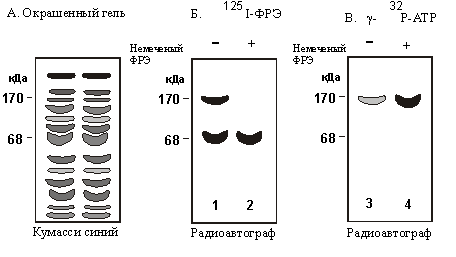
А. ДСН-гель препарата
мембран из клеток А-431.
Б. ДСН-гель препарата
мембран из клеток А-431, инкубированных с 125I-ФPЭ
и со сшивающим белки агентом в присутствии и в
отсутствие избытка меченого ФРЭ.
В. ДСН-гель
осажденного с помощью антител рецептора ФРЭ,
инкубированного с g -32Р-АТР в присутствии и
в отсутствие ФРЭ.
а) Какой из опытов
наиболее четко демонстрирует, что белок с мол.
массой 170 кДа является рецептором ФРЭ?
б) Является ли
рецептор ФРЭ субстратом для ФРЭ-стимулируемой
протеинкиназы? Как это можно определить?
в) Какие опыты
показывают, что рецептор ФРЭ представляет собой
протеинкиназу?
г) Можно ли сделать
вывод, что рецептор ФРЭ служит субстратом для
своей собственной протеинкиназной активности?
80. Используя обычные
сокращения для аминокислот, напишите все
возможные трипептиды, содержащие гистидин,
метионин и лизин.
81. Пепсин желудочного
сока (рН 1,5) имеет изоэлектрическую точку около 1,0.
Какие функциональные группы должны
присутствовать в пепсине в относительно большом
числе, чтобы этот фермент мог иметь такую низкую
изоэлектрическую точку? Какие аминокислоты
имеют эти группы в своем составе?
82. Расскажите, что Вы
знаете о природе различных типов связи и их роли
в структуре белков:
а) пептидной связи;
б) дисульфидной связи;
в) водородных связей;
г) электростатических
взаимодействий;
д) гидрофобных
взаимодействий.
83. Что такое
простетическая группа, протеаза, транспептидная
связь, олигомерный белок, денатурация, нативная
конформация, высаливание, аффинная
хроматография, незаменимые аминокислоты?
84. Определите
направление миграции при электрофорезе (к аноду
или катоду) для перечисленных ниже аминокислот и
пептидов при заданном значении рН:
а) глу (рН 7);
б) глу (рН 1), асп-гис. (рН
1), асп-гис. (рН 10).
85. Многие белки
содержат ковалентно связанные углеводные
остатки. Как правило, местом присоединения
углеводов к белку являются окси-аминокислоты.
Назовите известные Вам окси-аминокислоты и
напишите их формулы.
86. Гистоны
представляют собой небольшие основные белки,
связывающиеся с ДНК в хроматине. Они содержат
относительно много положительно заряженных
аминокислот, радикалы которых взаимодействуют с
отрицательно заряженными остатками фосфорной
кислоты в ДНК.
Предположите, какие
диаминомонокарбоновые кислоты входят в состав
молекул гистонов. Напишите их формулы.
87. Напишите
структурную формулу пентапептида следующего
строения:
Цис - Арг -
Фен - Глу - Три
а) Обозначьте N- и
С-концы пептида.
б) Отметьте регулярно
повторяющиеся группы, образующие пептидный
остов и радикалы аминокислот.
в) Какие из изученных
Вами цветных реакций будут положительны с данным
пептидом?
88. О чем позволяют
судить цветные реакции на белки?
а) О наличии белков в
биологических жидкостях.
б) О первичной
структуре белка.
в) О наличии некоторых
аминокислот в белках.
г) О функциях белков.
89. Определите
последовательность аминокислот в тетрапептиде,
используя следующие данные.
а) При анализе
N-концевой аминокислоты и аминокислотного
состава пептида получено: Асп-(Про, Тир, Мет).
б) После гидролиза
бромистым цианом, который расщепляет связи с
участием карбоксильной группы метионина,
образуется трипептид, содержащий Тир, Мет, Асп.
90. На рисунке
представлены функциональные группы аминокислот,
образующие в белках определенные типы связей
("А-Е").

а) Назовите типы
связей, которые могут возникнуть между
функциональными группами каждой пары,
обозначенной прописной буквой.
б) Выпишите номера пар,
участвующих в формировании вторичной и
третичной структуры.
91. Из приведенных ниже
аминокислот выберите те, радикалы которых могут
участвовать в образовании водородных связей:
Асп, Асн, Глн,
Глу, Сер, Вал, Лиз, Гис, Гли.
92. Подберите к каждому
уровню структурной организации белка
соответствующее понятие. Ответ дайте в форме
соответствия прописных и строчных букв
(например, "А" - "б").
А. Первичная
структура. В. Третичная структура.
Б. Вторичная
структура. Г. Четвертичная структура.
а) Конформация
пептидного остова, в формировании которой
участвуют водородные связи между пептидными
группировками.
б) Порядок чередования
аминокислот в белках.
в) Пространственное
расположение и характер взаимодействия
пептидных цепей в олигомерном белке.
г) Конформация
полипептидной цепи, стабилизированная
межрадикальными связями.
93. Выберите правильное
определение первичной структуры белка.
а) Аминокислотный
состав полипептидной цепи.
б) Линейная структура
полипептидной цепи, образованная ковалентными
связями между радикалами аминокислот.
в) Порядок чередования
аминокислот, соединенных пептидными связями в
белке.
г) Структура
полипептидной цепи, стабилизированная
водородными связями между атомами пептидного
остова.
94. Выберите правильное
определение четвертичной структуры белка.
а) Способ укладки
полипептидной цепи в пространстве.
б) Пространственное
расположение полипептидных цепей в виде
фибриллярных структур.
в) Количество
протомеров, их расположение относительно друг
друга и характер связей между ними в олигомерном
белке.
г) Порядок чередования
аминокислот в полипептидной цепи.
д) Способ укладки
полипептидной цепи в виде a -спиралей и b
-структур.
95. Какие из
перечисленных ниже взаимодействий обусловлены
комплементарностью молекул?
а) Белка с лигандом.
б) Протомеров в
олигомерном белке.
в) Белка с диполями
воды в растворе.
г) Функционально
связанных ферментов при формировании
полиферментных комплексов.
д) Различных белков в
процессе самосборки клеточных органелл.
е) Радикалов
аминокислот при формировании третичной
структуры белка.
96. Что представляет
собой центр узнавания белка лигандом?
а) Совокупность
радикалов аминокислот, сближенных на уровне
третичной структуры.
б) Фрагмент пептидного
остова.
в) Простетическую
небелковую группу.
г) Участок белка,
комплементарный лиганду.
97. Какие процессы
обусловлены способностью белков к специфическим
взаимодействиям с лигандами?
а) Образование
надмолекулярных структур клетки.
б) Межклеточные
взаимодействия в тканях.
в) Транспорт веществ
через биологические мембраны.
г) Упорядоченность
химических превращений веществ в клетках.
98. Верно ли
утверждение, что многие лекарственные вещества
взаимодействуют с определенными белками
организма, потому что они являются структурными
аналогами природных лигандов этих белков?
99. Цитохром с -
митохондриальный белок, участвующий в переносе
электронов в процессах биологического
окисления. Изучены аминокислотные
последовательности этого белка более чем у 100
видов. Количество аминокислотных замен по
сравнению с цитохромом человека (всего 104
аминокислоты) у шимпанзе, кенгуру, змеи и пшеницы
- 0, 10, 14 и 35 соответственно. Какие общие
закономерности связи первичной структуры и
функции белков подтверждаются этими данными?
Выберите правильные ответы.
а) Значительное
совпадение первичной структуры разных белков,
выполняющих сходные, но неодинаковые функции.
б) Большое сходство
белков, выполняющих у разных видов одну и ту же
функцию (сходство первичных структур более чем
на 50% является достаточно большим).
в) Связь между
эволюционной близостью видов и сходством
первичной структуры белков, выполняющих одну и
ту же функцию.
г) Влияние отдельных
аминокислотных замен на функцию белка.
100. Чем сопровождается
денатурация белков?
а) Нарушением большого
числа межрадикальных связей.
б) Уменьшением
растворимости.
в) Нарушением
пространственной структуры.
г) Изменением
первичной структуры.
101. Высаливание - один
из методов фракционирования белков.
а) Выделите свойство
белков, которое в наибольшей мере зависит от
концентрации солей: